Decisão da Anvisa deixa Brasil mais perto de dez milhões de doses da Sputnik até março
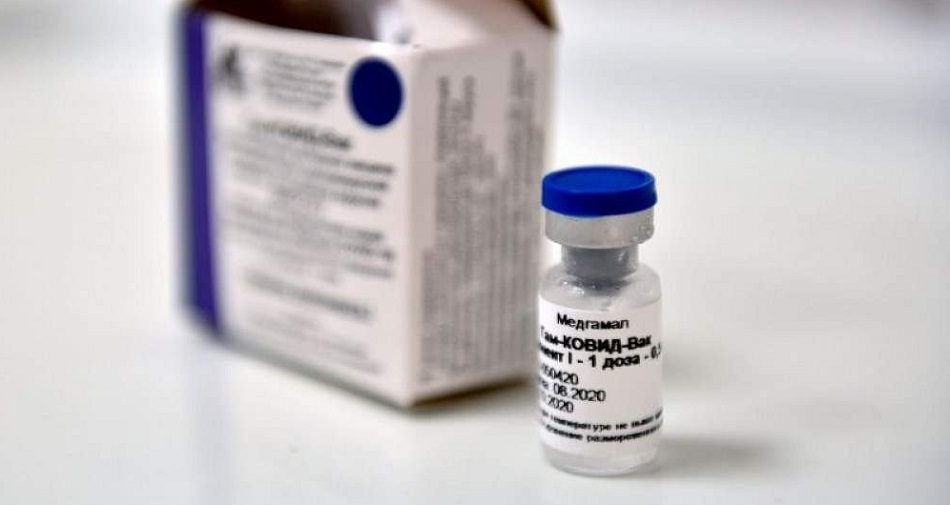
Após a confirmação sobre a eficácia de 91,6%, reconhecida em publicação na revista The Lancet, e a retirada da necessidade do estudo clínico de fase 3 no Brasil para solicitar o uso emergencial de um imunizante, a Sputnik V se tornou forte candidata a ser incorporada ao Programa Nacional de Imunização (PNI). Os responsáveis pela vacina russa apostam na aprovação do uso emergencial pela Agência Nacional de Vigilância Sanitária (Anvisa) ainda “nos próximos dias”.
Dez milhões de doses – Os desenvolvedores russos – com representantes da União Química, responsável pela produção da Sputnik V no Brasil – se reúnem, nesta sexta-feira, 5, com o Ministério da Saúde para fechar a compra de 10 milhões de doses prontas, programadas para chegar entre fevereiro e março. O diretor de Negócios Internacionais da empresa que reproduzirá o fármaco no país, Rogério Rosso, estima o início da imunização com a vacina russa entre o fim de fevereiro e início de março.
Ele explica não ser necessário recomeçar do zero o processo de uso emergencial por se encontrar apenas interrompido na Anvisa. A União Química havia apresentado o pedido à agência, que devolveu os documentos por não apresentarem requisitos mínimos.
“O pedido foi gerado em 15 de janeiro e interrompido por não haver estudo de fase 3 no Brasil. Retirado esse pré-requisito, a avaliação pode prosseguir com complementação de todos os documentos ainda necessários”, afirma Rosso.
Na quarta-feira, 3, ao excluir a obrigatoriedade dos testes no Brasil para o pedido de uso emergencial, a Anvisa explicou que o pedido da Sputnik V foi devolvido à União Química em 16 de janeiro, para que a empresa avalie os documentos e os reenvie. “Faltam informações basicamente relacionadas aos estudos que foram conduzidos na Rússia e outra sobre a fabricação da vacina no local de origem”, salientou o gerente-geral de Medicamentos e Produtos Biológicos da Anvisa, Gustavo Mendes.
Complementar os dados não será um problema, garante Rosso. “A Anvisa demanda os dados brutos, que serão todos disponibilizados. Há, no entanto, a necessidade de adequar as informações geradas na Rússia ao padrão brasileiro”, observou. Por ser um processo já debatido e avaliado é que o diretor aposta no aval para a aplicação antes do prazo estipulado.
No tempo regulamentar, a Anvisa tem 30 dias para avaliar se autoriza o uso emergencial da Sputnik V, regra que se aplica às candidatas sem testes em voluntários brasileiros. Já a análise de iniciativas testadas em território nacional precisa ser feita em até 10 dias.
Rosso enxerga com entusiasmo as novidades que dão peso à vacina russa e acredita que será a próxima a ser incorporada ao Programa Nacional de Imunização (PNI). “A publicação da eficácia de 91,6% em uma das revistas científicas de maior peso comprova a potência da Sputnik V, que tem a vantagem de poder ser produzida inteiramente no Brasil, dando a autonomia necessária neste cenário de escassez”, explicou.
Produção nacional – Por enquanto, a Sputnik V é a única que tem o Ingrediente Farmacêutico Ativo (IFA) já sendo produzido em território nacional. A vacina Oxford/AstraZeneca e a CoronaVac, apesar de preverem transferência tecnológica para produção independente, ainda não incorporaram totalmente o procedimento e, por isso, precisam de importar o IFA.
Medida provisória – E, na quinta-feira, 4, à noite, o Senado aprovou uma medida provisória que facilita a aquisição da Sputnik V – o texto aprovado segue, agora, para sanção do presidente Jair Bolsonaro. A MP também autoriza a adesão do Brasil ao consórcio multilateral Covax Facility, cuja participação carecia de regramento pelo Legislativo, pois era em caráter precário.
A medida também amplia a lista de países que servem como parâmetro para a liberação de vacinas para uso emergencial, pela Anvisa, em até cinco dias. Rússia, Argentina e Coreia do Sul se somam aos Estados Unidos, Japão, China e à agência de regulação de saúde da União Europeia. Atualmente, o prazo estipulado pela agência para avaliar pedidos sem testagem nacional é de até 30 dias.
Fonte: Correio Braziliense




